
从全血中分选细胞,您用的是什么方法呢?需要花多长时间呢?
表1. 推荐的体积和试管容量
| 样本体积(mL) | 试管容量(mL) | PBS+2%FBS(mL) | 密度梯度离心液(mL) |
|---|---|---|---|
|
1 |
5 |
1 |
1.5 |
|
2 |
14 |
2 |
3 |
|
3 |
14 |
3 |
3 |
|
4 |
14 |
4 |
4 |
|
5 |
50 |
5 |
15 |
|
10 |
50 |
10 |
15 |
|
15 |
50 |
15 |
15 |
6. 在室温1200g离心20分钟,关闭刹车。
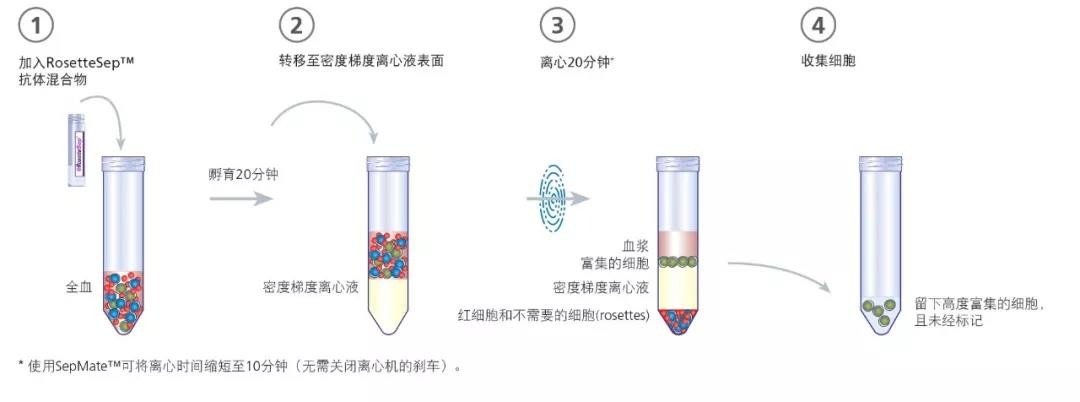
NK细胞和白细胞的高通量分选步骤
传统的从血液中分选白细胞的方法耗时耗力,并需要细致和专业的操作。通常需先使用密度梯度离心法分离外周血单个核细胞(PBMCs),然后使用基于分离柱的免疫磁珠分选系统来进行细胞亚群的富集。使用这些传统方法,从450ml血液中分选高纯度的自然杀伤细胞(NK细胞)操作过程漫长(最长需4小时),并且使用这些方法很难较快且高效地处理多个样本1。
新的RosetteSep™和SepMate™体系可以更快更高效地处理血液样本,且不会损伤细胞在下游分析中的功能或性能。马里兰大学医学院的Ajay Jain教授和他的同事在日常工作中,需要从大量的人源样本中分选NK细胞。为了简化工作流程并实现高通量的样本处理,Jain教授的实验室采用了新的RosetteSep™和Sepmate™细胞分选体系来取代他们以前使用的分选柱方法。
如需要详细的实验方法,请参阅Journal of Immunological Methods上的文献1。
参考文献
1. So E.C et al. (2013) A high throughput method for enrichment of natural killer cells and lymphocytes and assessment of in vitro cytotoxicity. J Immunol Methods 394(1–2): 40–48.