
Western blot是蛋白表达验证中最常用的实验检测手段之一,在实验中很多小伙伴经常会遇到杂不出目的条带,观察条带大小与预估大小不相同,或是杂带等情况。关于wb条带位置与预期不相符的情况,在之前的推文中,小编已经给大家做过一些介绍。今天,关于这个经典的问题,我们再来细细聊一聊。
Western blot主要实验流程有样品制备、SDS-PAGE电泳、转膜、封闭、抗体孵育、蛋白检测等。
很多时候,Western blot结果不理想,与样品制备有很大关系。关于样品制备,小编给大家总结了几点注意事项。

之前,小编收到客户投诉,购买的磷酸化抗体杂不出目的条带。经厂家技术专家分析,客户检测的磷酸化靶标,样本需要有合适的刺激才会表达。而客户的刺激条件不合适,样本不表达目的靶标,因此抗体检测不到目的条带。客户采纳厂家技术专家的建议,成功地杂出了目的条带。
也有客户购买抗体后,一直杂不出条带,做了很多次,结果总是“白板”。客户怀疑是抗体的问题,找到小编投诉。经过厂家技术专家的分析,客户用的细胞系本身不表达此蛋白,换了细胞系后,杂出了目的条带,并且抗体的特异性非常好。
另外还有客户购买抗体后,杂不出目的条带,怀疑抗体质量有问题,经过厂家复检,客户用的细胞系表达丰度很低,建议客户超声处理样品,并增大上样量。最终客户做出了满意的结果。
关于“杂带”的问题,也许您所看到的“杂带”并不杂,很可能是您忽略了以下问题。
蛋白的翻译后修饰经常会引起蛋白在SDS-PAGE 凝胶中的表观分子量不同于根据氨基酸序列换算出的预测分子量。这些修饰包括磷酸化,甲基化,乙酰化,泛素化以及SUMO化等等。样品中某一蛋白同时存在不同的修饰时,经常会造成膜上检测出多个条带。
翻译后剪切也是一方面的原因。各种mRNA剪切体的不同表达模式也可以改变分子量,不同的样本模型也可能是一方面的原因。对于部分蛋白存在的特殊结构,如:p53蛋白表观分子量是53kDa(这也是该蛋白名字的由来),但是根据氨基酸序列计算得到的分子量却是43kDa。
除了以上各种情况,SDS-PAGE 凝胶的成分和跑胶的条件以及预染marker自身所带电荷也都是一些重要的影响因子。
关于SDS-PAGE电泳,小编总结了几点注意事项,供大家参考。
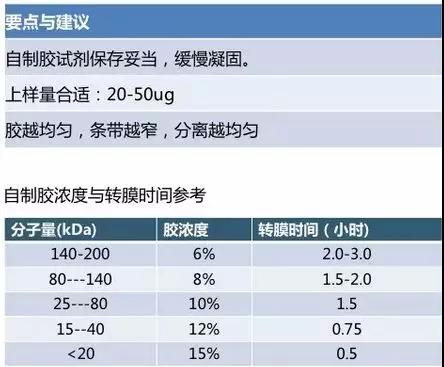
电泳时,PH 值和浓度准确性很重要,避免跑的过程中胶发热,发烫。
关于转膜,Western blot 常用的膜有2 种,PVDF 和NC 膜,通常我们更推荐0.2um 的NC 膜,背景更干净,适合常见的所有大小的靶蛋白。转膜方法有湿转、半干转、干转。湿转更完全,应用更广,是我们更推荐的方法。转膜效率可以用丽春红染料染下膜来判断。
蛋白转移到膜上之后,膜上还有许多地方是没有蛋白的,需要将膜进行封闭,以减少抗体与空白膜的非特异性结合。封闭推荐用5% 脱脂奶粉配置在1*TBST 里,若是荧光WB,封闭液里不加Tween20。
抗体孵育和检测,是做Western blot的关键步骤。好的抗体需要具备高特异性、高灵敏度、可重复性等特点。友谊中联代理金普来,为您提供蛋白电泳所需的各种耗材。

友谊中联致力成为中国生物科学和生物产业的引导者,代理品牌抗体均经过厂家严格验证,特异性强,灵敏度高,批次间稳定,为您的实验保驾护航!
上一篇:免疫荧光,您需要的都在这里!
下一篇:IHC常见问题疑难解答